ITESM Campus Puebla
Integrantes:
Juan Carlos López Medina A01324506
Arturo Tlelo Reyes A01099697
Carla María Barceló Chong A01099195
Iván Eduardo Teáhulos Castillo A01324895
Responsables del laboratorio:
Mtro. Victor Hugo Blanco Lozano
Dr. Isaac Monroy
Ácidos, Bases y Medidas de pH.
Objetivos: Preparar soluciones partiendo de distintos tipos de concentración y realizar diluciones de las mismas. Y medir el pH, pOH e H+ de distintas soluciones.
La disolución viene a ser una mezcla homogénea, conformada en una sola fase, por dos o más sustancias. Se le llama disolvente al componente que se encuentra en mayor proporción siendo el soluto el que se encuentra en menor proporción. Dichas disoluciones no necesariamente involucran un soluto p.e: polvo en el aire, aleaciones (unión de dos metales). Ya que al agregar un soluto a un líquido el primero modifica las propiedades de éste último se debe de medir el soluto, en proporción de molécula de soluto por molécula de disolvente, para poder así predecir las propiedades que tendrá nuestra disolución. Entre esas medidas tenemos:
Molaridad (M):

Molalidad (m):

Fracción molar(X):

Porcentaje en peso:

Partes por millón:

Normalidad:
*

pH, pOH, H+ :
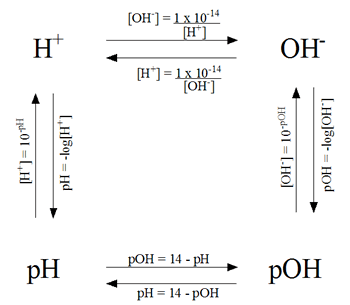 |
| Conversor |
La auto ionización de agua nos comprueba que en cualquier muestra de agua existe una pequeña cantidad de iones de hidroxilo (OH+) y de iones de hidrógeno.
El grado de ionización al disolverse en agua nos da la fortaleza de un ácido o base.
El metro de pH es un instrumento que nos ayuda a medir el voltaje o potencial generado entre dos electrodos sumergidos en solución experimental. Para esto se hace uso de un electrodo de referencia y otro de vidrio, el cual es sensible a la concentración de H3O que se encuentra en la solución.
Experimento 1: Disoluciones y medición de pH
Para este experimento, cada equipo eligió dos de las sustancias de las siguientes.
- · Cloruro de sodio
- · Dextrosa
- · Hidróxido de sodio
- · Cloruro de potasio
- · Ácido clorhídrico
- · Ácido sulfúrico
- · Hidróxido de amonio
- · Vinagre
Se eligió la dextrosa, que consistía en una disolución de 250 ml al 1.5% y otra de ácido clorhídrico al 0.1N. A continuación se muestran los cálculos hechos para obtener el volumen necesario de soluto.
Para la disolución de dextrosa se usó la fórmula de %masa/volumen en el que la masa fue medida en gr y el volumen en litros. A continuación se muestra el cálculo para la obtención de la masa necesaria.
Despejando la fórmula, se obtienen 3.75 gr de dextrosa (C6H12O6) que fueron puestos en un matraz aforado para después llenarlo hasta la marca de 250 mL.
Para el caso del HCl, se hicieron los cálculos de normalidad siguiendo la sig. ecuación.
Ya teniendo ambas disoluciones, se usó un medidor de pH para medir su acidez o alcalinidad.
Despejando la fórmula, se obtienen 3.75 gr de dextrosa (C6H12O6) que fueron puestos en un matraz aforado para después llenarlo hasta la marca de 250 mL.
 |
| Masa de la dextrosa |
 |
| Matraz aforado con el agua y la dextrosa |
Para el caso del HCl, se hicieron los cálculos de normalidad siguiendo la sig. ecuación.
Para encontrar el número de eq-gr, se usó la siguiente fórmula
Se sustituyen los valores conociendo que la masa molar del HCl es de 36.46 gr/mol y que el HCl tiene una partícula equivalente por cada mol.
Se ancla la parte anterior en la original para obtener la masa necesaria (en gr) de HCl.
Se usa la densidad del HCl para encontrar el volumen necesario para preparar la disolución. Que finalmente es de 0.1624 mL.
 |
| Disolución al 0.1 N de HCl |
 |
| pH del HCl. Un ácido fuerte |
 |
| pH de la dextrosa casi neutro |
Una vez obtenidos los resultados, se procedió a llenar la siguiente tabla. Los datos de las demás sustancias fueron proporcionados por otros equipos. Para obtener las medidas de [H+] y de pOH se usaron las fórmulas del conversor mostrado al principio de este reporte.
Disolución de:
|
Concentración
|
Cantidad (mL)
|
pH
|
[H+]
|
pOH
|
Cloruro de sodio
|
2%
|
250
|
7.52
|
3 x 10-8
|
6.48
|
Dextrosa
|
1.5%
|
250
|
7.03
|
9.33 x 10-8
|
6.97
|
Hidróxido de sodio
|
1.0 M
|
100
|
13.45
|
3.54 x10-14
|
0.55
|
Cloruro de potasio
|
0.2 M
|
100
|
7.48
|
||
Ácido clorhídrico
|
0.1 N
|
50
|
1.43
|
3.715 x 10-2
|
12.47
|
Ácido sulfúrico
|
1.5 N
|
50
|
0.07
|
1.99 x 10-1
|
13.93
|
Hidróxido de amonio
|
0.1 N
|
50
|
10.14
|
||
Vinagre
|
0.75N a 0.2 N
|
50
|
2.69
|
11.31
|
Discusión:
Hacer el cálculo de las concentraciones llevó una buena parte del tiempo de este experimento debido a la falta de conocimiento de las fórmulas de concentración. Se espera que con el tiempo estos cálculos sean más rápidos.
Por otro lado, los pH de las sales analizadas pueden diferir de los datos experimentales ya hechos porque los electrodos pudieron no ser lavados con agua destilada correctamente.
Experimento 2: Preparación de soluciones ácidas y uso de indicadores:
Lo que se procedió a realizar para este experimento
fue numerar 4 tubos de ensaye del 1 al 4, a continuación, se colocaron 10 ml. de HCL 0.1
N previamente preparado, en el primer tubo.
Extracción
del 10 ml de HCl
Posteriormente, se pipeteo 1 ml. de la solución del primer tubo y se agregó al
tubo 2, seguido de esto, se agregaron 9 ml. de agua destilada, así pues, se consiguió
una nueva concentración (0.01 M). A partir de esta solución se prepararon otras
2 soluciones más, utilizando 1 ml. de la última solución que se preparó.
Solución original de Ácido clorhídrico
Porta tubos con muestras de las 4 soluciones
Seguido de esto, se colocaron 12 tubos de ensaye
sobre un porta tubos; el cual se dividió entre las 4 soluciones obtenidas, es
decir por cada muestra de los tubos 1 al 4 hubieron 3 tubos de ensaye en los
cuales se agregaron 2 gotas del indicador correspondiente. Cabe señalar que se tenía
pensado utilizar verde bromocresol, azul de metilo y amarillo de alizarina; sin
embargo, fueron cambiados por azul de metilo, naranja de metilo y fenolftaleína,
respectivamente.
Muestras con indicadores de la solución 1Muestra con indicadores de la solución 2
Muestra con indicadores de la solución 3
Muestra con indicadores de la solución 4
Soluciones
acuosas
|
Fenolftaleína
|
Azul de
bromotimol
|
Naranja
de metilo
|
1
|
Incoloro
|
Amarillo
|
Rojo
|
2
|
Incoloro
|
Amarillo
|
rojo
|
3
|
incoloro
|
Amarillo
|
rojo
|
4
|
Rosa
|
Azul
|
amarillo
|
Discusión:
Al observar la tabla de resultados y comparar los
colores obtenidos con los valores en la Tabla 1 proporcionada en la práctica,
podemos decir que la solución uno es ácida al igual que la solución dos y la
tres. Sin embargo la solución cuatro se torna aparentemente básica, un hecho
inusual debido a que la solución original era básica. Probablemente los tubos
de ensaye tenían residuos de jabón dejados por el equipo anterior, un
acontecimiento ajeno a nuestro consentimiento.
Experimento 3: Preparación de soluciones básicas y uso de indicadores.
Éste es una variación del experimento 2. Aquí se utilizó una disolución al 0.1 M de NaOH del que se tomó una alícuota de 1 ml para hacer una disolución al 0.01 Molar. Se fue tomando un mililitro de éste para hacer otra disolución. En total se tenían 4 tubos de ensayo numerados del 13 (0.1 N) al 10(0.0001).
Se usó Naranja de metilo, fenoftaleína y arándano como indicadores para conocer el grado de alcalinidad de las disoluciones. Con cada uno de los 4 tubos preparados se hicieron 3 tubos para hacer pruebas con los indicadores. Éstos contenían aproximadamente un ml de la solución.
Se utilizaron dos gotas de los indicadores. A continuación se muestra la coloración presentada en cada uno de los tubos de ensayo. Se añadieron a los tubos de ensayo en el siguiente orden: fenoftaleína, arándano y naranja de metilo.
 |
| Gradilla con los tubos de ensayo y la coloración presentada. |
 |
| 1. Detalle de la coloración de la disolución al 0.0001 |
 | |
|
 | |
|
 | |
|
Se puede apreciar cómo la coloración de los reactivos es más baja conforme baja la concentración de NaOH en la disolución acuosa. Para el caso del arándano es apreciable un leve color amarillo en la concentración al 0.1 M.
En la siguiente tabla se muestra un resumen de las coloraciones
Soluciones acuosas
|
Fenolftaleína
|
Arándano
|
Naranja de metilo
|
13
|
Rosa
|
Amarillo (poco apreciable)
|
Naranja
|
12
|
Rosa
|
Incoloro
|
Naranja claro
|
11
|
Rosa
|
Incoloro
|
Naranja
|
10
|
Rosa claro
|
Incoloro
|
Naranja
|
Discusión:
Se consideran que los resultados obtenidos con la fenoftaleína fueron satisfactorios, pues el indicador muestra el color correspondiente al rango de pH, sin embargo, no se puede decir lo mismo del naranja de metilo. Este tiene una coloración prácticamente naranja cuando se supone que éste debería tornarse color amarillo con una base fuerte
Experimento 4: Preparación de indicador derivado de fruta o planta.
-En un mortero se machacó el pimiento morrón rojo y se le añadieron 2.3 mL de alcohol isopropílico y se continuó machacando hasta que se formara un extraño color (un rojo tornasol)
 |
| Pimiento morrón molido con 2.3 mL de alcohol isopropílico |
Se procedió a formar 2 grupos de tubos de ensayo, 4 contenían bases (NaOH) y 4 contenían ácidos (HCl), dentro de cada tubo se colocó una muestra del pimiento morrón rojo previamente preparado. El siguiente paso consistió en añadirle a cada muestra dos gotas del indicador establecido para ser comparado con el color de la muestra original.
 |
| Añadir leyenda |
Discusión: Con este indicador preparado por nosotros, las bases no presentan un cambio de coloración (todas se quedan de coloración naranja), mientras que en las bases el color naranja se va tornando más claro.
Experimento 5: Uso de indicadores para estimar el pH de los productos de uso doméstico.
Parte I:
-En un vidrio de reloj se colocarón dos papeles tornasol (1 azul, 1 rojo)

-Se procedió a sumergir la punta de un agitador en la muestra de vinagre y colocar una gota en cada papel tornasol, se hizo lo mismo con la muestra de amoniaco. Si el papel azul se tornaba rosa significaba que la muestra era una sustancia ácida, mientras que si el papel rosa se tornaba azul estábamos tratando con una base.
-Resultados:
Al añadir el vinagre el papel tornasol rosa no cambió de color mientras que el azul se volvió rosa, lo que nos indica que dicha sustancia es ácida. Mientras que al añadir amoniaco al papel tornasol rosa éste se volvió azul y el azul no cambió de color, lo que indica que se trataba de una sustancia base.
Parte II:
-Se colocaron en la gradilla 8 tubos de ensayo, 4 tendrían vinagre incoloro (vinagre blanc) y los otros 4 el limpiador con amoniaco.
-La gradilla se rotulo para los dos grupos de muestra y se prosiguió a rotular el indicador que se le añadiría a cada una quedando con la siguiente numeración:
1.- Azul de bromotimol
2.-Naranja de metilo
3.-Fenolftaleína
4.-Extracto de planta (pimiento morrón rojo)
-Se añadieron dos gotas del indicador establecido para cada muestra y se procedió a observar los resultados.
 |
| De izquierda a derecha: 4 tubos vinagre, 4 tubos limpiador con amoniaco. |
Vinagre
incoloro
|
Limpiador
con amoniaco
|
|
Azul de bromotimol
|
Amarillo claro
|
Amarillo fuerte
|
Naranja de metilo
|
Rojo
|
Amarillo fuerte
|
Fenolftaleína
|
Blanco
|
Amarillo claro
|
Extracto de planta
|
Anaranjado claro
|
Naranja
|
Discusión:
En esta parte si se puede apreciar un cambio en el naranja de metilo, pues en el vinagre (ácido acético), la coloración se tornó roja y en la básica naranja claro. Esto a pesar de que el vinagre es un ácido moderado y el ácido clorhídrico un ácido fuerte. No se apreció el color azul en cuanto al azul de bromotimol en el medio básico y la fenoftaleína no tuvo un cambio rosa en el vinagre. El indicador del extracto de planta, como el experimento 4, se torna naranja fuerte en presencia de ácidos y no cambia de color en medios básicos.
Conclusión:
es de suma importancia conocer y preparar disoluciones para
llevar a cabo la experimentación. En un principio puede resultar difícil hacer
los cálculos para encontrar la cantidad de soluto necesaria para preparar una
solución, pero con el tiempo se espera que este tipo de cálculos y
preparaciones se vuelvan familiares para nosotros. Se considera que, aunque
tomaron su tiempo, los cálculos se hicieron adecuadamente.
En lo que concierne al uso de indicadores, éstos son muy
útiles para determinar con un método cualitativo si una solución acuosa es
básica o ácida y si es fuerte, media o débil. Incluso se pueden usar
indicadores hechos por uno mismo. En cuanto a los resultados obtenidos, se
obtuvo mejores resultados con la fenolftaleína que con el naranja de metilo o
el azul de bromotimol. El primero no presentó un cambio amarillo en las bases y
el segundo se tornó azul en una disolución ácida (ya se dijo que se debe
probablemente a restos de jabón dejados por el equipo anterior). Se debe tener
cuidado con el material pues ya se ha dicho que no se garantiza que esté 100%
limpio. Los ácidos y bases están a nuestro alrededor y son de mucha ayuda como
medios acuosos de reacción, para reacciones de neutralización y como uso doméstico.
Cuestionario:
1.-El ácido clorhídrico es un ácido fuerte. Halle la concentración de H3O y OH en una
solución de HCl 0.25 M.
Concentración de H3O+ 0.25M
Concentración de OH- 3.99 x 10^(14) M
2.-Calcule el pH de una solución para la cual H3O es 3.4x10-3 M.
pH= 2.46
3.-Si el pH de una solución es 4.30, calcule la concentración de H3O en la solución.
5.011 x 10^(-5)
4.-Determine si una solución será acida, básica o neutral conociendo la sig. información:
a) pH=10.20 básica
b) [H3O] = 3.4x10-3 M ácida
c) pOH = 2.10 básica
d) H3O = OH neutra
e) OH = 6.2x10-12 M ácida
5.- Considérese el caso de una muestra de agua de rio a la que se desea medir su concentración de carbonatos, cloruros y sulfatos. Ya que la concentración de estos iones en el agua de rio se nota muy alta como para realizar la medición directamente, normalmente se procede a diluir la muestra, antes de realizar la medición propiamente dicha.
Supóngase entonces que se toman 50 mL de la muestra original en un matraz aforado y se diluyen a 500 mL de agua destilada. Luego de homogeneizar la disolución recién preparada, se toman 20 mL de esta disolución en un matraz aforado y se diluyen nuevamente en un matraz aforado a 500 mL con agua destilada. Si posteriormente se realizan las determinaciones sobre la segunda disolución y se encuentra que en ellas las concentraciones de calcio, cloruro y magnesio son respectivamente 25, 95 y 55 ppm ¿Cuál será entonces la concentración de estos elementos en la muestra original?
Concentración 6250 calcio
Concentración 23750 cloruro
Concentración 13750 magnesio
6.- Suponga que un vertimiento de aguas negras residuales de 10 litros por segundos que contiene 525 mg/L de ion cloruro descarga a un cauce receptor de 85 litros por segundo que contiene 10 mg/L de ion cloruro. Calcule cuál será el efecto sobre el cuerpo de aguas receptor.
El cauce será de 95 L/s a 64.21 mg/L
7:- a) Cual será el volumen de agua que se debe agregarse a 500 ml de una solución 1.5M de NaOH para hacerla 0.250 M y b) Una solución de NaOH concentrada está al 19.3 M y tiene una densidad de 1.53 g/ml. ¿Cuál es el porcentaje en masa de la solución?
a) 3000 mL
b) 50.39%
8. Preparar 250 mL de disolución 0,1 M de CuSO4, partiendo del comercial: CuSO4 . 5 H2O. ¿ Cuánto se debe pesar de reactivo hidratado?
6.24 gr de CuSO4 . 5 H2O
9.- ¿Cuántos litros de agua oxigenada al 30% deben combinarse, con cuántos litros de agua oxigenada al 5%, para obtener 25 litros de una solución de agua oxigenada al 15%?
Concentración de H3O+ 0.25M
Concentración de OH- 3.99 x 10^(14) M
2.-Calcule el pH de una solución para la cual H3O es 3.4x10-3 M.
pH= 2.46
3.-Si el pH de una solución es 4.30, calcule la concentración de H3O en la solución.
5.011 x 10^(-5)
4.-Determine si una solución será acida, básica o neutral conociendo la sig. información:
a) pH=10.20 básica
b) [H3O] = 3.4x10-3 M ácida
c) pOH = 2.10 básica
d) H3O = OH neutra
e) OH = 6.2x10-12 M ácida
5.- Considérese el caso de una muestra de agua de rio a la que se desea medir su concentración de carbonatos, cloruros y sulfatos. Ya que la concentración de estos iones en el agua de rio se nota muy alta como para realizar la medición directamente, normalmente se procede a diluir la muestra, antes de realizar la medición propiamente dicha.
Supóngase entonces que se toman 50 mL de la muestra original en un matraz aforado y se diluyen a 500 mL de agua destilada. Luego de homogeneizar la disolución recién preparada, se toman 20 mL de esta disolución en un matraz aforado y se diluyen nuevamente en un matraz aforado a 500 mL con agua destilada. Si posteriormente se realizan las determinaciones sobre la segunda disolución y se encuentra que en ellas las concentraciones de calcio, cloruro y magnesio son respectivamente 25, 95 y 55 ppm ¿Cuál será entonces la concentración de estos elementos en la muestra original?
Concentración 6250 calcio
Concentración 23750 cloruro
Concentración 13750 magnesio
6.- Suponga que un vertimiento de aguas negras residuales de 10 litros por segundos que contiene 525 mg/L de ion cloruro descarga a un cauce receptor de 85 litros por segundo que contiene 10 mg/L de ion cloruro. Calcule cuál será el efecto sobre el cuerpo de aguas receptor.
El cauce será de 95 L/s a 64.21 mg/L
7:- a) Cual será el volumen de agua que se debe agregarse a 500 ml de una solución 1.5M de NaOH para hacerla 0.250 M y b) Una solución de NaOH concentrada está al 19.3 M y tiene una densidad de 1.53 g/ml. ¿Cuál es el porcentaje en masa de la solución?
a) 3000 mL
b) 50.39%
8. Preparar 250 mL de disolución 0,1 M de CuSO4, partiendo del comercial: CuSO4 . 5 H2O. ¿ Cuánto se debe pesar de reactivo hidratado?
6.24 gr de CuSO4 . 5 H2O
9.- ¿Cuántos litros de agua oxigenada al 30% deben combinarse, con cuántos litros de agua oxigenada al 5%, para obtener 25 litros de una solución de agua oxigenada al 15%?
Volumen de agua al 5%= 15
Referencias:
-GuateQuímica . (2010). Jmol. Recuperado el 11
de Febrero de 2013, de
http://www.guatequimica.com/tutoriales/soluciones/Normalidad.htm

+09.09.06.png)
+09.09.15.png)
+09.09.27.png)
+09.09.47.png)
+09.09.51.png)
+09.09.55.png)
+09.10.31.png)
+13.16.20.png)






