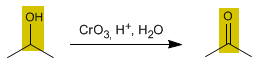ITESM Campus Puebla
Integrantes:
Juan Carlos López Medina A01324506
Arturo Tlelo Reyes A01099697
Carla María Barceló Chong A01099195
Iván Eduardo Teáhulos Castillo A01324895
Responsables del laboratorio:
Mtro. Victor Hugo Blanco Lozano
Dr. Isaac Monroy
Propiedades de los alcoholes y síntesis de aldehídos y cetonas
Objetivo: Estudiar las propiedades de los alcoholes, así como por medio de su oxidación obtener aldehídos y/o cetonas.
Introducción:
-Los alcoholes se dividen en primarios, secundarios y terciarios en base el número de carbonos adyacentes al carbono que están unidos, y es esto lo que les brinda distintas características. Por medio de la oxidación de los mismos se pueden obtener cetonas y aldehídos, para lograrlo se utilizará un oxidante fuerte (dicromato de potasio) que es de un color anaranjado intenso (Cr2O7)^-2 en su estado natural, mientras que al fungir como oxidante pasa a ser Cr^+3, que es de un color verde brillante. Esto nos indica que si un alcohol pasa a ser una cetona o un aldehído además de diferenciarlos por el olor habrá un cambio de color perceptible.
Experimento I. Solubilidad
Procedimiento:
- Se
determinó la solubilidad relativa del
etanol, isopropanol, metanol y glicerina en agua y éter.
- Para esto
se agregaron 10 gotas del alcohol problema a 1 ml del solvente.
La glicerina no se pudo disolver debido a que es un compuesto polar y el éter es un compuesto no polar por lo tanto no se podrán disolver entre ellos. Aunque se haya marcado que si disuelve para los grupos de alcoholes está solvencia es relativa ya que no se puede observar claramente, pero
-Observaciones:
-Observaciones:
(Fue
difícil comprobar a simple vista la presencia de dos capas distintas de
líquidos cuando ambas son incoloras).
Experimento II. Reacciones de esterificación de alcoholes
Los esteres son el producto de
la reacción entre los alcoholes y los ácidos carboxílicos. Con formación de
agua, para que se lleve a cabo la reacción es necesaria además la presencia de
un ácido como el ácido sulfúrico, que funciona como catalizador.
La reacción en el sentido
opuesto se conoce como hidrólisis del éster, pues el agua rompe el enlace éster
para formar nuevamente el ácido y el alcohol.
Procedimiento:
- Se rotularon
tres tubos de ensaye con los componentes a mezclar:
1) Alcohol
etílico, 2) alcohol isopropílico, 3) alcohol metílico.
- Se
puso 1.5ml de cada uno y después se añadieron 1.5ml de ácido acético en el caso
de la 1ª esterificación, y 8 gotas de
ácido sulfúrico concentrado como catalizador.
- La
mezcla se calentó en baño maría hasta ebullición. Se dejó 3 minutos más y se
vertió la mezcla sobre 25ml de agua helada contenida en un vaso de precipitado.
 |
| Las muestras de alcoholes se colocaron a baño maría |
 |
| Se añadió la muestra, después de 3 minutos, al agua helada |
Resultados:
Esterificación
|
Muestra
del alcohol
|
Tipo
de ácido
|
Catalizador
|
Olor
|
Reacción
química
|
1ª
|
Alcohol
etílico
|
Acético
(ácido etanoico) |
Ácido
sulfúrico
|
acetona
|
|
1ª
|
Alcohol
isopropílico
|
Acético
(ácido etanoico) |
Ácido
sulfúrico
|
entre cetona y alcohol, un olor avinagrado
|
|
1ª
|
Alcohol
metílico
|
Acético
(ácido etanoico) |
Ácido
sulfúrico
|
más fuerte que un alcohol etílico
|
- Discusión:
¿agradable o desagradable?
Los
olores no eran desagradables pero eran muy fuertes e intensos y un poco difícil de diferenciarlos debido a la misma intensidad.
Otro
problema a la hora de calentar fue que se evaporaban rápidamente y al poner un
tapón esté salía despedido por la presión.
Experimento III. Oxidación de los alcoholes
El objetivo de este experimento es analizar la formación de aldehídos y cetonas a partir de la oxidación de alcoholes.
Para este experimento, se rotularon tres tubos de
ensaye con el nombre del alcohol que a estudiar (alcohol etílico, isopropílico y
metílico).
Se agregó 1ml de alcohol en
cada tubo de acuerdo al nombre etiquetado.
Se agregaron 20 gotas de ácido sulfúrico diluido como catalizador y 5 gotas de permanganato de potasio, dicromato de potasio y cromato de potasio.
- Se calentaron
ligeramente y se registró el olor para cada producto.
Prueba 1: Oxidación con cromato de potasio (K2CrO4):
Oxidante débil
Oxidante débil
El cromato de potasio originalmente es de un color amarillo brillante.
Alcohol (muestra)
|
Compuesto formado
|
Olor
|
Observaciones
|
Etílico
|
Ácido etanoico (ácido acético)
|
Huele ligeramente a piña
|
Cambia de color naranja y finalmente amarillo.
|
Isopropílico
|
Propanona (acetona)
|
Huele a un alcohol frutal
|
Pasa de amarillo a naranja y finalmente se pone de un color verde
|
metilico
|
metanal (formaldehído)
|
no se aprecia un olor aparente
|
Pasa de amarillo a naranja y finalmente se pone de un color verdoso.
|
 |
| Oxidación de alcoholes. Izquierda: alcohol isopropílico. Centro: Etanol. Derecha: metanol. |
Oxidante fuerte
El dicromato de potasio inicialmente es color naranja brillante.
Alcohol (muestra)
|
Compuesto formado
|
Olor
|
Observaciones
|
Etílico
|
Etanal
|
piña
|
Color amarillo a un verde casi claro. Es una reacción exotérmica pues se calienta un poco el tubo.
|
Isopropílico
|
Propanona (acetona)
|
alcohol con un toque de acetona
|
Pasó de un amarillo a un verde claro.
|
metilico
|
metanal (formaldehído)
|
no se apreció un olor aparente
|
La oxidación es muy lenta y no hay un cambio de color apreciable.
|
 |
| Oxidación con dicromato de potasio. |
Prueba 3: Oxidación con permanganato de potasio (KMNO4):
Oxidante fuerte
El permanganato de potasio es de color morado muy oscuro.
El permanganato de potasio es de color morado muy oscuro.
Alcohol (muestra)
|
Compuesto formado
|
Olor
|
Observaciones
|
Etílico
|
Ácido etanoico (ácido acético)
y formación de etanol |
frutal con otro compuesto no conocido
|
Se oxida formando un precipitado color café
|
Isopropílico
|
Propanona (acetona)
|
alcohólico
|
Se observa un cambio de color a café con restos de algún compuesto flotando
|
metilico
|
Metanal (formaldehído) y metanal
|
no se pudo apreciar un olor conocido
|
Se aprecia un color entre morado-café con un compuesto disuelto.
|
Discusión: El uso de oxidantes fuertes como el dicromato de potasio y el permanganato de potasio, puede llevar a la formación rápida de aldehídos y cetonas. Sin embargo, algunas de las moléculas sufren de una oxidación vigorosa que lleva a la formación de ácidos carboxílicos; esto se puede apreciar principalmente con el KMNO4 . En cambio, con el KCrO4 , la oxidación es débil y no permite que todas las moléculas cambien de alcohol a aldehído o cetona; es por esto que no se aprecian bien los aromas y persiste un aroma a alcohólico.
En el caso del alcohol metílico, éste casi no presentó una oxidación fuerte con el KCrO4 y el KCrO7 , pues el cambio de color no fue tan apreciable. Sin embargo, sí hubo una oxidación excesiva con el
KMNO4 que llevó a la formación de un ácido carboxílico. En el caso de los aldehídos formados, el etanal es el único que tiene un aroma agradable a frutas.
En cuanto a los precipitados formados, estos eran parte de los productos formados en la reacción de KMNO4 , que además de formar compuestos orgánicos, también se forma KOH que no es soluble en en este tipo de solventes.
Experimento IV. Reacción de Tollens para identificación de aldehídos
* Reacción positiva para aldehídos,
negativa para cetonas.
Procedimiento:
* El reactivo de Tollens
(hidróxido de plata amoniacal) ya se encontraba preparado en el laboratorio.
- A 5 gotas de cada substancia
muestra se añadieron 5 gotas del reactivo de Tollens.
- Se agitaron y calentaron en
baño de agua brevemente.
Tiempos de calentamiento
|
|
Sacarosa
|
2:30 mins
|
Glucosa
|
00:58 segs
|
Fructuosa
|
00:40 segs
|
Lactosa
|
2:20 mins
|
Maltosa
|
2:00 mins
|
* La aparición de un espejo de
plata indicaba prueba positiva.
Resultados:
Muestra
|
Reacción (+) o (-)
|
Tipo de azúcar
|
A
|
-
|
Sacarosa
|
B
|
+
|
Glucosa
|
C
|
+
|
Fructuosa
|
D
|
+
|
Lactosa
|
E
|
+
|
Maltosa
|
 |
| Positivos a espejo de plata menos sacarosa, primer tubo de derecha a izquierda |
- La glucosa y la fructosa son las únicas soluciones que debieron resultar positivas en dicha prueba, ya que son las únicas que presentan un grupo aldehído. Por lo que suponemos que las muestras se contaminaron debido a un mal uso de las pipetas.
Conclusiones:
- El reconocimiento y síntesis de los compuestos comprendidos en esta práctica nos permite comprender un poco mejor la importancia de los alcoholes y los grupos hidroxilos ya que a partir de éstos por distintos métodos, en este caso el de la oxidación, se pueden obtener otros compuestos como aldehídos, cetonas y ácidos carboxílicos. La prueba de Tollens resulta muy útil para demostrar si el compuesto que hemos sintetizado o que ya teníamos previamente es un aldehído o una cetona, también se puede saber por el olor pero debido a la subjetividad del mismo es mejor realizar una prueba más contundente como ésa.
Cuestionario:
1) Explicar el mecanismo de
solubilidad del glicerol en éter.
El glicerol es una sustancia polar que es un buen disolvente perfectamente miscible en agua y en alcoholes debido a sus grupos hidroxilos , mientras que en éter es totalmente inmiscible, esto se debe a que éste es una sustancia no polar y la regla de miscibilidad constata que, hablando de sustancias, polar solvata a polar y no polar solvata a no polar.
El glicerol es una sustancia polar que es un buen disolvente perfectamente miscible en agua y en alcoholes debido a sus grupos hidroxilos , mientras que en éter es totalmente inmiscible, esto se debe a que éste es una sustancia no polar y la regla de miscibilidad constata que, hablando de sustancias, polar solvata a polar y no polar solvata a no polar.
2) Escribir la reacción química
que se efectúa al reaccionar el etanol con sodio. ¿Qué gas se desprende de esa
reacción?
3) Escribe la estructura de los
productos de oxidación esperados en la oxidación de los alcoholes usados en tu
experimento. Si no observaste reacción con ninguno de los alcoholes explica por
qué.
Álcohol etílico --> Ácido etanoico

-------------->


------------->
Alcohol Isopropílico --> Propanona


----------->
4) ¿Cómo identificó el grupo
carbonilo en aldehídos y cetonas?
 |
| El grupo carbonilo se encuentra constituido por un enlace polar |
La oxidación de alcoholes primarios nos da como resultado la formación de aldehídos mientras que la oxidación de alcoholes secundarios forma cetonas.
5) Escriba la reacción que
permitió dicha identificación.
-Oxidación de alcoholes primarios a aldehídos:
-Oxidación de alcoholes secundarios a cetonas:
-Oxidación de alcoholes primarios a aldehídos:
-Oxidación de alcoholes secundarios a cetonas:
6) ¿Cómo diferenció a un
aldehído de una cetona?
Debido al enlace polar que nos genera el grupo carbonilo, el carbón al que se encuentran unidos se vuelve un electrófilo permitiendo que se lleve a cabo la reacción de la prueba de Tollens que nos formará un espejo de plata si el compuesto que se está identificando es un aldehído.
Debido al enlace polar que nos genera el grupo carbonilo, el carbón al que se encuentran unidos se vuelve un electrófilo permitiendo que se lleve a cabo la reacción de la prueba de Tollens que nos formará un espejo de plata si el compuesto que se está identificando es un aldehído.
7) Escriba la o las reacciones
que le permitieron diferenciar uno de otro.
Referencias:
- Fernández, G. (18 de Noviembre de 2008). Químimca
Orgánica . Recuperado el 25 de Marzo de 2013, de
http://www.quimicaorganica.org/acidos-carboxilicos/429-sintesis-de-esteres-a-partir-de-acidos-carboxilicos-esterificacion.html
- Junta de Andalucía . (s.f.). Aldehídos y Cetonas .
Recuperado el 02 de Abril de 2013, de
http://www.juntadeandalucia.es/averroes/recursos_informaticos/concurso1998/accesit8/cac.htm
-Universidad de las Palmas de Gran Canaria . (s.f.). UPGC:
Reacciones Aldehídos-Cetonas . Recuperado el 01 de Abril de 2013, de
http://www.ulpgc.es/descargadirecta.php?codigo_archivo=4538
-Germán, F. (16 de Noviembre de 2008). Química
Orgánica . Recuperado el 02 de Abril de 2013, de
http://www.quimicaorganica.org/alcoholes/418-oxidacion-de-alcoholes.html